Nature Metab | 揭示驱动肿瘤发生的表观遗传调控新机制
癌基因cMyc是一个重要的转录因子,调控约15%的人类基因表达,在肿瘤细胞的增殖、凋亡以及代谢重编程等方面发挥重要作用。然而,目前尚不清楚,cMyc是否通过转录以外的机制,来广泛地调控基因的表达以及肿瘤的发生发展。
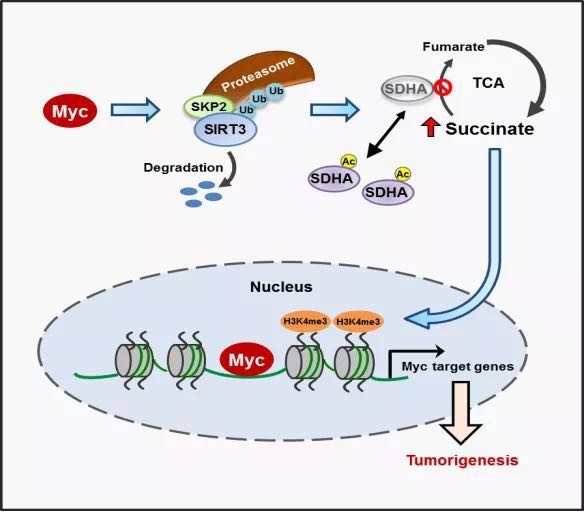
中国科学技术大学张华凤课题组、高平课题组联合军事医学科学院段小涛课题组研究发现,cMyc能够促使琥珀酸脱氢复合酶(SDH complex)中的重要亚基SDHA乙酰化以及SDH复合酶失活,导致底物琥珀酸(succinate)的积累,进而上调组蛋白H3K4的三甲基化(H3K4Me3)水平以及基因的表达。机制方面,发现cMyc通过泛素连接酶SKP2促进线粒体中SIRT3的蛋白降解,从而导致SDHA的乙酰化水平上升。
体内外实验证实,cMyc调控SDHA的乙酰化位点K335能够显著影响肿瘤进程。进一步分析临床病人弥散性大B细胞瘤(DLBCL)样本发现,高表达cMyc的DLBCLs中,SIRT3发挥着抑癌因子的功能,而K335位乙酰化的SDHA发挥着促进肿瘤的作用。
实验揭示了cMyc驱动的肿瘤发生过程中SDHA乙酰化修饰发挥的重要病理学作用。SDHA被认为是抑癌蛋白,它的失活突变体与多种肿瘤,例如副神经结瘤、乳腺癌、肾癌等,有一定程度的联系。
研究表明,至少在弥散性大B细胞淋巴瘤中,SDHA通过乙酰化失活而极大地促进了cMyc异常表达的肿瘤的进展。因此,靶向乙酰化SDHA将可能为此类肿瘤的临床治疗提供潜在的策略和手段。

该文章于2020年3月16日发表在Nature Metabolism杂志(IF=22.154)上。
实验部分利用TissueFAXS Cytometry技术对免疫组化样本进行成像和定量分析。
实验方法
将55个DLBCL样品分为两组,一组具有高Myc表达(27个样品的MOD≥50%),另一组具有相对较低的Myc表达(28个样品的MOD <50%)。免疫组化样本图像及分析结果显示SIRT3蛋白呈阴性,而Lys 335-乙酰化的SDHA和H3K4me3呈阳性,与Myc表达相关。
在对临床DLBCL和正常淋巴结免疫组化样本分析得出,在低Myc表达的DLBCL和高Myc表达的正常淋巴结样本中,SIRT3蛋白水平逐渐下降,而Lys 335乙酰化的SDHA和H3K4me3水平逐渐升高。
实验数据
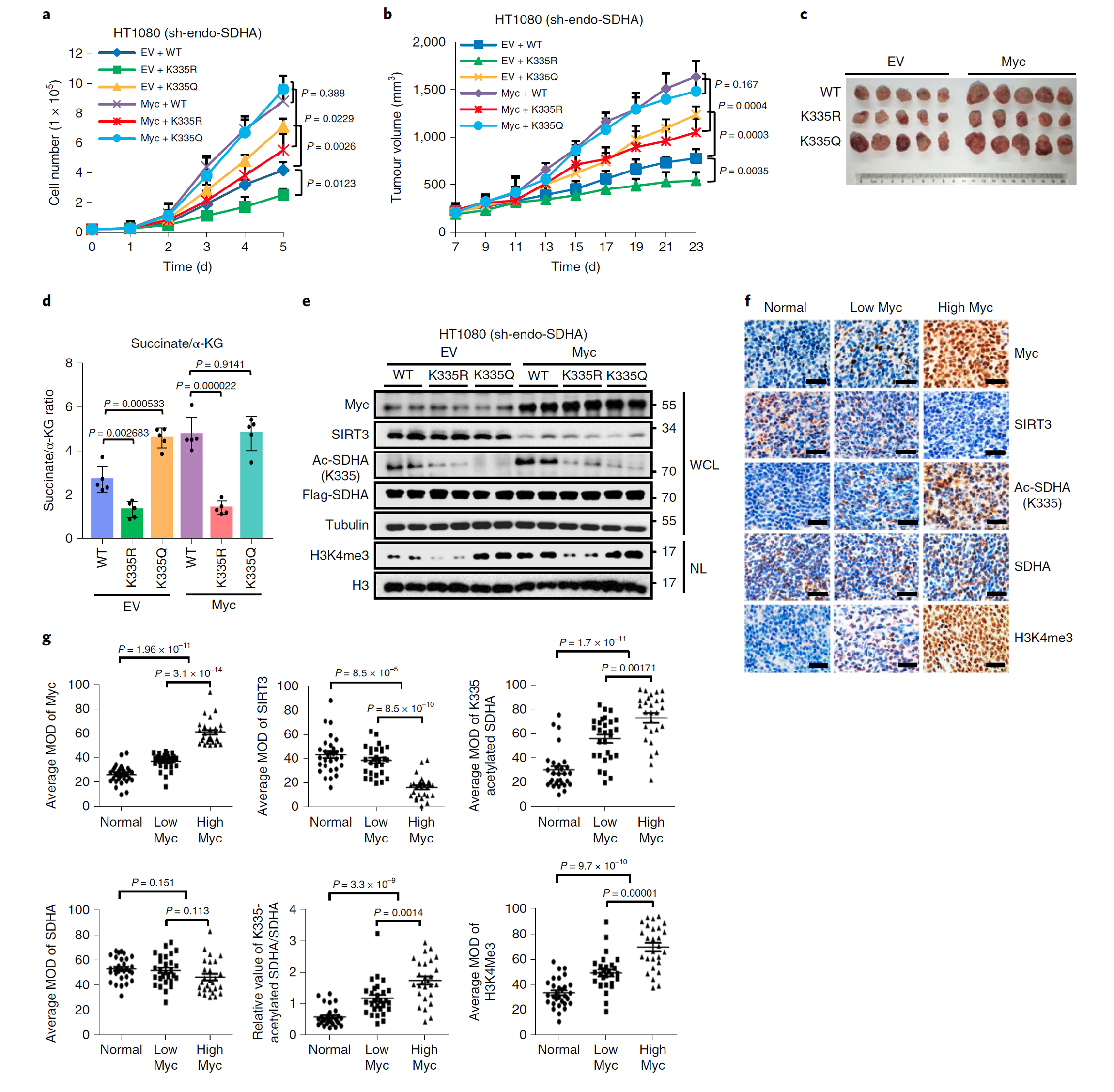
F:低表达Myc的DLBCL样本、高表达Myc的DLBCL样本和正常组织中的Myc,SIRT3,SDHA,SDHA和H3K4me3的Lys 335乙酰化的免疫组化图像。
G:利用HistoQuest软件对f图中的样本进行平均强度定量分析。
使用HistoQuest软件对图像进行量化进一步提供了统计结果,表明Myc表达与SIRT3蛋白水平呈负相关,与DLBCLs中Lys 335乙酰化的SDHA和H3K4me3水平呈正相关。
因此,临床数据显示Lys 335乙酰化的SDHA可能作为弥散性大B细胞淋巴瘤潜在的生物标记物。
https://www.nature.com/articles/s42255-020-0179-8#citeas
